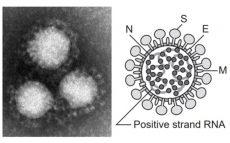
日本での新型コロナワクチン~接種開始はいつから?
公開: 更新:
ニッポン放送「飯田浩司のOK! Cozy up!」(12月8日放送)に参議院議員で自由民主党新型コロナ対策本部・本部長代理の武見敬三が出演。日本における新型コロナウイルスのワクチン接種の開始時期について解説した。
いかに迅速に薬事承認を勧めるか、国民への不安を払拭してもらえるかが課題
インド主要メディアは12月7日、イギリスの製薬大手アストラゼネカとオックスフォード大学が開発する新型コロナウイルスのワクチンについて、ライセンス生産するインド血清研究所が、緊急使用許可をインド薬品規制当局に申請したと報じた。薬品規制当局はインドの他、イギリスとブラジルでの治験結果から承認の可否を判断する見通しである。
飯田)新型コロナウイルスのワクチンについてですが、いよいよイギリスでは接種というところまで来ています。インドも動いています。
武見)ワクチンをできるだけ早く薬事承認して、リスクの高い人、高齢者、医療従事者、介護従事者等に早く打って、収束に向かわせる。そのための決定的な課題がワクチンです。いずれの国も急いでいます。日本もアストラゼネカ社とファイザー社のワクチンについては、既に第1相と第2相の臨床試験をやっています。これについては、PMDA(薬事承認局)の担当者とも事前の相談ができていて、実際に薬事承認の手続きに入るのは年明けくらいからになると思います。
豚インフルエンザワクチンのときは3ヵ月で承認~それでも遅く、使うころには収束
武見)2009年に豚インフルエンザが発生した際、同じようにカナダの製薬企業からワクチンを輸入して、そのときは特例承認というやり方で、3ヵ月で承認しました。承認した後、品質検定検査というものがあります。それを今度は国立感染症研究所がやるので、さらに3週間かかります。だいたい3ヵ月と3週間でした。今回はどの程度短縮でき、安全性と有効性を測定して、国民の皆さんに不安なく積極的に予防接種に応じて下さるようにできるか。そのために、情報を公開しながら、どう薬事審査を進めて行くかということが、これからの課題です。
飯田)その部分で「拙速ではないか?」という批判もあります。豚インフルエンザ、あの当時は新型インフルエンザと言われたものですよね。そのときも4ヵ月弱くらいの期間で承認したという実績があるのですね。
武見)それでも遅かった。450億円くらいでカナダのワクチンを買ったのですが、実際に使うころには収束していたので、何と450億円分、全部捨ててしまいました。今回は日本も7社ほどと既にMOUという契約を結び、「開発されたら購入する」という約束をしていますから、どこかの時点で余るという現象が出て来る可能性はあります。
飯田)そうですか。でも余るくらいあればいいですよね。
ワクチン保管のためのマイナス70度に保てる冷凍庫を3000台製造済み
武見)とにかく日常生活を1日も早く取り戻すというのが、我々の政策の目標ですから、安全性と有効性を確認した上で、迅速に予防接種ができる仕組みをつくる必要があります。その準備が大変なのですが、例えばファイザー社のワクチンは、マイナス70度で保管しなければ品質が管理できません。そのために特別な冷凍庫を3000台つくりました。
飯田)もうすでにあるのですか?
武見)つくりました。それをさらに増産して各地域で提供できるようにするということを進めています。ただ、1000ドース、1000回分のパッケージごとに運ぶものですので、それを今度は分割して冷凍ボックスに入れ替え、地域の医療機関で接種するということになります。その運搬中の品質管理ができるかどうか、そこも検査しなければなりません。
人種によってワクチン投与量も変わるのか
飯田)以前、電話で武見さんに話を伺ったときに、例えば欧米のアングロサクソンと日本人では反応が違うのではないかというご指摘もありました。
武見)人種差というのは、いろいろなところで出て来ます。出て来ないときもある。実際に10月中旬からファイザー社の1相、2相の試験をやっています。安全性と有効性の視点から、投与量も人種差に関わる重要なところです。「日本人には、投与量をどの程度にすることが最も効果的で適切か」ということを第1相、第2相の臨床試験のなかで行います。そこで投与量が決まると、通常であれば第3相の臨床試験を行います。そして、数万人を対象にした上で、その結果を踏まえて薬事申請に入って行くというのが普通のプロセスです。
飯田)通常は、というところですね。
感染者数が欧米と比べて少ない日本では第3相試験ができない~第3相試験を省いて第4相試験に
武見)ところが日本の場合、感染者数が欧米と比べて少ないので、4万人、5万人の臨床治験がなかなかできない。実際の治験では、半分にプラセボというニセ薬を提供して、その効果を比較して有効性を測定するのですが、日本では第3相試験ができないのです。やろうとすると、とてつもない時間がかかってしまう。従って、日本では第3相試験は省いて、薬事申請をして、その結果、通常の第4相の試験をプラセボを使わないでやってみる。まずは1万人程度の医療従事者、またリスクの高い人を対象として、副反応などをトレース、確認をして、それを第4相試験として始める。その後、一般の人に広げて行くというやり方を日本はやるのだと思います。
飯田)それはどれくらいの時期になりそうでしょうか?
武見)1月くらいから薬事申請の手続きが始まって、それから特例承認にするのだろうと思います。そこで緊急接種という形で実行しますので、豚インフルエンザのときの3ヵ月をどこまで縮小できるか。国民が不安に思うといけないから、情報公開はきちんとして、安全性と有効性についての説明を常に継続して行う。これがこれから求められて行きます。
ニッポン放送「飯田浩司のOK! Cozy up!」
予防接種の薬事承認の過程と同時にデジタル化のシステム設計を進める
飯田)一方で、厚生労働省側は何かあってはいけないと、アビガンの承認も時間がかかりました。慎重に行きたがる厚労省をバックアップするような形になるのですか?
武見)厚労省が慎重であるのは当然です。しかし今回は世界規模のパンデミックになって、経済活動や社会活動がここまで深刻化しています。緊急時、有事の対応として、薬事承認の手続きを短縮させるというのは当然です。それは厚労省もよくわかっています。もちろん、それを科学的なエビデンスを無視してやってはいけません。それをきちんと踏まえて国民が不安を持たないように情報公開をして、迅速化を行う。そういう姿勢が正しいと思います。
飯田)過去にあったワクチン忌避みたいなものにしてはいけないわけですね。
武見)絶対にいけません。しかし、何億という人たちに接種するのですから、副反応は必ず起こります。その結果として、訴訟問題は必ず起きます。その点について政府として、副反応が起きた場合には、すぐに副反応であることを特定化して診断できる仕組み、そしてすぐにそれをPMDAという薬事承認局に報告する仕組み、これをデジタル化する。予防接種を受けた人たちの健康状態を管理できるデジタル化のシステム設計を同時にやろうとしています。
国内メーカーでもワクチンの製造ができる体制に
飯田)何かあった人を国が救済するというのは、この間の予防接種法の改正でも……。
武見)明確にしました。製薬企業の製造物責任ではなく、それを国が保証することによって、海外の開発メーカーが日本との交渉に応じたのです。本来ならば、国内に競争力のある開発メーカーがあれば、日本の立場も交渉上、強く出られたのですが、残念ながら、日本のなかに先進的な遺伝子組み換えを通じた新たなワクチンを開発する技術を持った企業が育っていません。
飯田)日本の企業にも頑張って欲しいですね。
武見)しかし、これを機会に国内各社もそれを開発する努力を始めましたから、これを最後までやらせることによって、日本の技術を蓄積して、近い将来、別の危険な感染症が現れた際に、国内でもワクチンの製造ができるという体制にしなければならないと思っています。
飯田)そこに科学技術予算もしっかりつけて行くということですか?
武見)今回、3次補正予算にも入っています。